Nikotinabhängigkeit/Fachartikel
Der folgende Artikel bezieht sich auf Geschlechterunterschiede bei Nikotinabhängigkeit. Geschlechterübergreifende Inhalte können Sie den AWMF-Leitlinien zu Tabakkonsum (Rauchen) entnehmen.
Inhaltsverzeichnis
Epidemiologie[Bearbeiten]
Inzidenz/Prävalenz[Bearbeiten]
Die Prävalenz beim Rauchen ist in Deutschland bei Männern mit 31.2 Prozent höher als bei Frauen mit 26.1 Prozent, wobei als Raucher bzw. Raucherin gilt, wer innerhalb der letzten 30 Tage eine Zigarette geraucht hat und zwischen 18 und 64 Jahre alt ist. Männer rauchen zudem öfter mehr Zigaretten pro Tag: Über 20 Zigaretten täglich rauchen 25.5 Prozent der Raucher und 16.6 Prozent der Raucherinnen. Hinweise auf Nikotin-Abhängigkeit (gemessen mit dem Fagerström-Test für Nikotinabhängigkeit (FTND)) liegen bei 10.8 Prozent der Männer und bei 8.2 Prozent der Frauen vor (vergleiche Tabelle 1).[1]
Tabelle 1. Tabakkonsum der 18- bis 64-Jährigen: Prävalenzen [95 %-Konfidenzintervalle] und Hochrechnung auf die Bevölkerung Deutschlands. [Quelle: De Matos et al. (2016)]
| Männer | Frauen | Gesamt | Hochrechnung | |
| Ein-Monats-Prävalenz Konsum | 31.2 [29.2; 33.3] | 26.1 [24.5; 27.7] | 28.7 [27.4; 30.0] | 14.64 Mio. |
| Starker Konsum (mind. 20 Zigaretten/Tag) | 25.5 [22.2; 29.2] | 16.6 [13.8; 19.8] | 21.4 [18.9; 24.1] | 2.93 Mio. |
| Klinisch relevanter Konsum (nach FTND) | 10.8 [9.4; 12.3] | 8.2 [7.1; 9.3] | 9.5 [8.6; 10.5] | 4.84 Mio. |
Der tägliche Konsum steigt tendenziell mit dem Alter, während Abhängigkeit häufiger in mittleren Kohorten zu beobachten ist.[2] Insgesamt rauchen etwa 12 Prozent der Jugendlichen zwischen 11 und 17 Jahren, in dieser Altersgruppe scheint es noch keine Geschlechterunterschiede in der Prävalenz zu geben. Jugendliche sind zudem meist Gelegenheitsrauchende. Geschlechterunterschiede in der Prävalenz prägen sich erst in Kohorten über 17 Jahren so aus, dass Männer unter rauchenden Personen überrepräsentiert sind.[3]
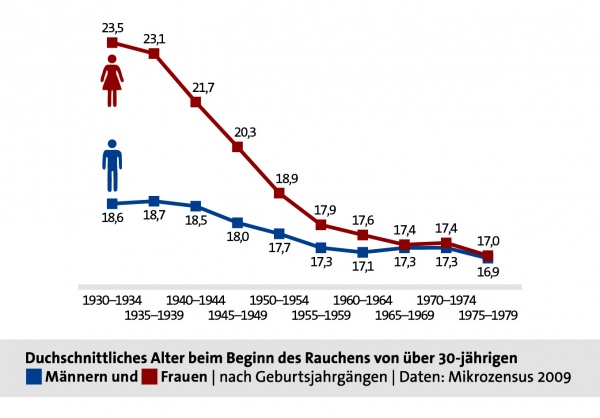
Der deutsche Tabakatlas 2015 gibt an, dass der Raucherinnenanteil bei Frauen erst gegen Mitte des 20. Jahrhunderts deutlich angestiegen ist. Bei Männern war das Rauchen bereits mehrere Jahrzehnte zuvor weit verbreitet. Betrachtet man die heute über 30-Jährigen, so nimmt das durchschnittliche Einstiegsalter über die Geburtsjahrgänge immer mehr ab, bei Frauen deutlich stärker als bei Männern, und gleicht sich im Geschlechtervergleich zunehmend an (vergleiche Grafik 1).[4]
Grafik 1. Durchschnittsalter bei Rauchbeginn (Frauen und Männer). [Quelle: Tabakatlas 2015, Pötschke-Langer et al. (2015), S. 37]
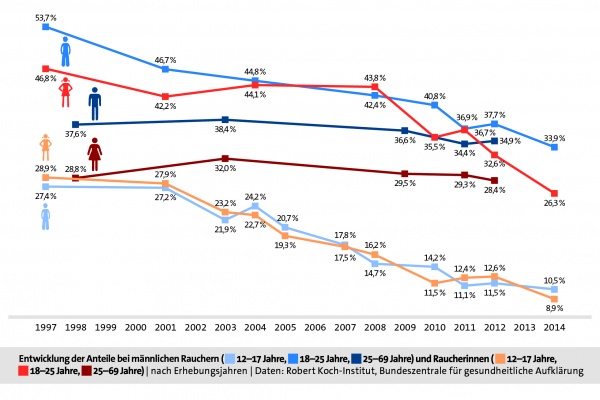
Seit mehreren Jahren sinken die Prävalenzen beim Rauchen in Deutschland in allen Altersgruppen. Bei Kindern und Jugendlichen ist der Trend zum Nichtrauchen am deutlichsten zu beobachten. So rauchten Ende der 1990er Jahre fast 30 Prozent der 12- bis 17-Jährigen, aktuell sind es nur noch ungefähr 10 Prozent. Die Veränderungen der Prävalenzen über verschiedene Erhebungsjahre, unterteilt nach Altersgruppe und Geschlecht, sind Grafik 2 zu entnehmen.[5]
Grafik 2. Prävalenz von RaucherInnen nach Altersgruppe und Erhebungsjahr. [Quelle: Tabakatlas 2015, Pötschke-Langer et al. (2015), S. 34]
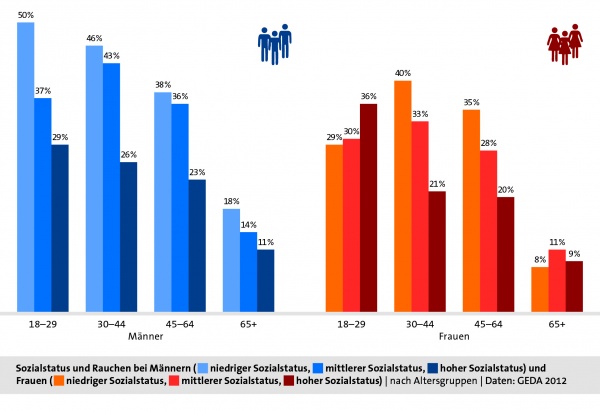
Das Rauchverhalten ist abhängig vom sozialen Status, der mittels Bildungsniveau, beruflicher Stellung und Einkommenssituation ermittelt wird. Seit mehreren Jahrzehnten rauchen mehr Männer und Frauen mit niedrigem sozialen Status als mit hohem sozialen Status. Bei Männern ist dieser soziale Unterschied im Rauchverhalten über alle Altergruppen hinweg zu beobachten, bei Frauen lediglich im mittleren Lebensalter (zwischen 30 bis 64 Jahren, vergleiche Grafik 3).[6]
Grafik 3. Sozialstatus von Rauchern und Raucherinnen. Mit steigendem Sozialstatus sinkt der Raucheranteil bei Männern in allen Altersgruppen, bei Frauen lediglich im mittleren Lebensalter.
[Quelle: Tabakatlas 2015, Pötschke-Langer et al. (2015), S. 44]
Risikofaktoren und protektive Faktoren[Bearbeiten]
Informationen zu Risikofaktoren und protektiven Faktoren von Substanzgebrauchsstörungen finden Sie hier.
Pathophysiologie[Bearbeiten]
Zahlreiche Unterschiede finden sich zwischen Männern und Frauen hinsichtlich des Nikotin-Stoffwechsels:[7] Das Leberenzym CYP2A6, das für den Abbau von Nikotin zu Cotinin zuständig ist, zeigt eine höhere Aktivität bei Frauen, weshalb Nikotin bei Frauen insgesamt schneller verstoffwechselt werden kann.[8] Die Aktivität von CYP2A6 wird vermutlich durch weibliche Hormone (insbesondere Östradiol) beeinflusst, da die Einnahme oraler Kontrazeptiva oder das Vorliegen einer Schwangerschaft den Nikotin-Stoffwechsel steigern, während Geschlechterunterschiede bezüglich der Aktivität zwischen Männern und Frauen, die in den Wechseljahren sind oder diese hinter sich haben, nicht besteht.[9] Im Zeitraum zwischen Follikel- und Lutealphase der Frau zeigen sich jedoch keine Geschlechterunterschiede beim Nikotin-Stoffwechsel.[10]
Auch Auslöser des Nikotin-Cravings können sich zwischen den Geschlechtern unterscheiden: Gründe für das Rauchen sind bei Männern häufig positive Verstärkungseffekte, während bei Frauen Emotionsregulation (Rauchen als Copingstrategie) und Reaktivität auf Hinweisreize öfter Auslöser für Craving sind.[11]
Es gibt Hinweise darauf, dass Frauen anfälliger für die schädlichen Effekte von Tabak sind.[12] Raucherinnen weisen ein erhöhtes Risiko für koronare Herzkrankheiten und für Herzinfarkte auf. Rauchen stellt für beide Geschlechter in gleichem Maße einen Risikofaktor für einen Schlaganfall dar. Die Wahrscheinlichkeit einer Lungenerkrankung ist bei rauchenden Frauen höher, senkt sich nach dem Rauchstopp bei Frauen allerdings auch schneller als bei Männern. Frauenspezifische Probleme sind eine verfrühte Menopause, stärkere Menstruationsblutungen sowie ein erhöhtes Risiko für spontane Fehlgeburten und für Schwierigkeiten, schwanger zu werden.[13]
Nikotinkonsum in der Schwangerschaft kann zudem schwerwiegende Folgen für das ungeborene Kind haben. Häufig ist das Geburtsgewicht sowie die Geburtsgröße verringert. So wiegen Kinder von Raucherinnen bei der Geburt durchschnittlich etwa 200 bis 300 Gramm weniger, sind kleiner und haben einen geringeren Kopfumfang als Kinder von Nichtraucherinnen. Zudem steigt für das Kind das Risiko für eine verringerte Lungenfunktion, für Fehlbildungen wie Gaumenspalten sowie für Verhaltens- und Konzentrationsstörungen (z. B. ADHS). Auch kommt es durch Rauchen während der Schwangerschaft vermehrt zum plötzlichen Kindstod.[14]
Klinik[Bearbeiten]
Symptome[Bearbeiten]
Allgemein gilt bei substanzbezogenen Störungen folgendes: Bedingt durch den telescoping effect (beschleunigter Verlauf der Abhängigkeit bei Frauen) zeigen Frauen, die eine Behandlung aufsuchen, häufig eine stärkere Abhängigkeit sowie eine höhere Prävalenz komorbider psychischer Störungen.[15] Sowohl Craving als auch Entzugserscheinungen sind bei Frauen stärker ausgeprägt. Verhaltensanalogien zeigen sich auch in Tierversuchen mit weiblichen und männlichen Nagern.[16]
Diagnostik[Bearbeiten]
Bei der Diagnostik von schädlichem und abhängigem Tabakkonsum sollte sich (unabhängig vom Geschlecht) unbedingt an der S3-Leitlinie “Screening, Diagnostik und Behandlung des schädlichen und abhängigen Tabakkonsums” orientiert werden:
Informationen zur Diagnostik von Substanzgebrauchsstörungen erhalten Sie hier.
Management von Patienten und Patientinnen[Bearbeiten]
Therapie[Bearbeiten]
Auch bei der Behandlung von schädlichem und abhängigem Tabakkonsum sollte sich (unabhängig vom Geschlecht) unbedingt an der S3-Leitlinie “Screening, Diagnostik und Behandlung des schädlichen und abhängigen Tabakkonsums” orientiert werden.
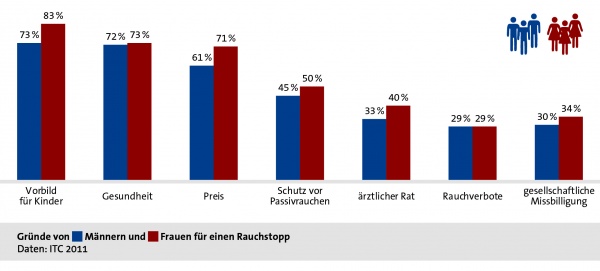
Bereits die Motivation, eine Therapie zu beginnen, kann sich zwischen den Geschlechtern unterscheiden. Nachfolgende Abbildung (Grafik 4) stellt Gründe von Männern und Frauen für einen Rauchstopp dar,[17] die innerhalb präventiver oder therapeutischer Maßnahmen durchaus eine Rolle spielen können.
Grafik 4. Gründe für einen Rauchstopp bei Männern und Frauen. [Quelle: Tabakatlas 2015, Pötschke-Langer et al. (2015), S. 34]
Interaktion zwischen Arzt/Ärztin und Patient/Patientin[Bearbeiten]
Informationen zur Interaktion zwischen ärztlichem Personal und Patienten sowie Patientinnen bei Substanzgebrauchsstörungen erhalten Sie hier.
Generell gilt: Der Rat des Arztes/der Ärztin (z. B. in Form einer Kurzintervention) stellt einen wichtigen Prädiktor für den Rauchstopp bei Männern und Frauen dar (vergleiche Grafik 4). [18] Kurzinterventionen sollten deshalb in der Praxis unbedingt verstärkt eingesetzt werden.
Behandlungserfolg/Outcome[Bearbeiten]
Nikotinersatztherapie
Männer scheinen mehr als Frauen von Nikotin-Pflastern oder Nikotin-Kaugummi zu profitieren. Bezüglich der Behandlung mit Nikotin-Pflastern wurde herausgefunden, dass mehr Frauen als Männer diese wegen Hautirritationen abbrechen.[19] Insgesamt ist die Befundlage jedoch uneindeutig.
Fluoxetin
Einer Studie zufolge verringert sequentielles Fluoxetin acht Wochen vor dem Rauchstopp nur bei Frauen depressive Symptome, den Entzug betreffende negative Affekte und das Craving.[20] Dabei standen für Frauen depressive Symptome, die vor dem Rauchstopp auftraten, sowie das Craving im Zusammenhang mit der Abstinenzdauer, während bei Männern mit dem Entzug verbundene negative Affekte mit der Abstinenzdauer zusammenhingen. Dagegen kann der S3-Leitlinie zufolge kein Wirksamkeitsbeleg für Fluoxetin gefunden werden.[21]
Bupropion
Bupropion scheint bei Frauen effektiver zu sein, wenn es darum geht, Abstinenz vom Rauchen aufrechtzuerhalten, was womöglich damit zusammenhängt, dass es die Gewichtszunahme bei einem Rauchstopp verringert.[22]
Der weibliche Zyklus
Der weibliche Zyklus beeinflusst den subjektiven Effekt von Drogen sowie physiologische Reaktionen und Entzugserscheinungen.[23] Insbesondere bei rauchenden Personen wurde versucht, sich die inhibitorische Wirkung von Progesteron zunutze zu machen, indem ein Rauchstopp in der Lutealphase (in welcher der Progesteron-Spiegel am höchsten ist) initiiert wurde. Die Befundlage sieht jedoch gemischt aus: In einigen Studien wurden Erfolge im Sinne längerer Zeit bis zu einem Rückfall berichtet, in anderen wurden hingegen keine Effekte der Zyklusphase auf den Behandlungserfolg festgestellt oder die Entzugserscheinungen waren in der Follikelphase sogar geringer.[24]
Psychosoziale Faktoren[Bearbeiten]
Informationen zu psychosozial wirksamen Faktoren bei Substanzgebrauchsstörungen erhalten Sie hier.
Prävention[Bearbeiten]
Ein geschlechterspezifisches Interventions- bzw. Präventionsprogramm stellt IRIS dar. IRIS wurde speziell für schwangere Frauen entwickelt. Teilnehmen können alle Schwangeren mit Tabak- oder Alkoholkonsum. Für Frauen mit einem Drogenkonsum ist das Angebot allerdings ungeeignet. Das Programm dauert 12 Wochen und ist tageszeit- und ortsunabhängig. Inhalte sind beispielsweise interaktive Online-Übungen, während derer man sich aktiv mit individuellen Bedürfnissen und Lösungsstrategien auseinandersetzen kann.
Mehr zum IRIS-Programm erfahren Sie hier.
Translation in die klinische Versorgung[Bearbeiten]
Offene Forschungsfragen[Bearbeiten]
Externe Links[Bearbeiten]
- S3-Leitlinie “Screening, Diagnostik und Behandlung des schädlichen und abhängigen Tabakkonsums” AWMF-Register Nr. 076-006
- IRIS-Programm: Hilfe für Schwangere beim Verzicht auf Alkohol und Tabak
Literatur[Bearbeiten]
- Elena Gomes de Matos, Josefine Atzendorf, Ludwig Kraus und Daniela Piontek (2016) Substanzkonsum in der Allgemeinbevölkerung in Deutschland. Ergebnisse des Epidemiologischen Suchtsurveys 2015. SUCHT (2016), 62 (5), 271–281, http://www.esa-survey.de/ DOI 10.1024/0939-5911/a000445.
- Pabst, A., Kraus, L., De Matos, E. G., & Piontek, D. (2013). Substanzkonsum und substanzbezogene Störungen in Deutschland im Jahr 2012. Sucht, 59(6), 321–331.
- Pötschke-Langer, M., Kahnert, S., Schaller, K., Verena, V., Heidt, C., Schunk, S., … Fode, K. (2015). Tabakatlas (1st ed.). Heidelberg: Deutsches Krebsforschungszentrum.
- Pötschke-Langer M, Kahnert S, Schaller K, Viarisio V: Tabakatlas 2015. Deutsches Krebsforschungszentrum in der Helmholtz-Gemeinschaft (dkfz). Im Zusammenarbeit mit: Robert-Koch-Institut, Universität Hohenheim, Institut für Therapieforschung (IFT). Gefördert von: Bundesministerium für Gesundheit.
- Pötschke-Langer M, Kahnert S, Schaller K, Viarisio V: Tabakatlas 2015. Deutsches Krebsforschungszentrum in der Helmholtz-Gemeinschaft (dkfz). Im Zusammenarbeit mit: Robert-Koch-Institut, Universität Hohenheim, Institut für Therapieforschung (IFT). Gefördert von: Bundesministerium für Gesundheit.
- Referenzfehler: Es ist ein ungültiger
<ref>-Tag vorhanden: Für die Referenz namenswurde kein Text angegeben. - Agabio, R., Pani, P. P., Preti, A., Gessa, G. L., & Franconi, F. (2016). Efficacy of Medications Approved for the Treatment of Alcohol Dependence and Alcohol Withdrawal Syndrome in Female Patients: A Descriptive Review. European Addiction Research, 22(1), 1–16.
- Franconi, F., Campesi, I., Occhioni, S., Antonini, P., & Murphy, M. F. (2013). Sex and Gender in Adverse Drug Events, Addiction, and Placebo. In Handbook of experimental pharmacology (pp.107–126).
- Agabio, R., Campesi, I., Pisanu, C., Gessa, G. L., & Franconi, F. (2016). Sex differences in substance use disorders: focus on side effects. Addiction Biology, 21(5), 1030–1042.
- Hukkanen, J., Gourlay, S. G., Kenkare, S., & Benowitz, N. L. (2005). Influence of menstrual cycle on cytochrome P450 2A6 activity and cardiovascular effects of nicotine*. Clinical Pharmacology & Therapeutics, 77(3), 159–169.
- Agabio, R., Campesi, I., Pisanu, C., Gessa, G. L., & Franconi, F. (2016). Sex differences in substance use disorders: focus on side effects. Addiction Biology, 21(5), 1030–1042.
- Agabio, R., Campesi, I., Pisanu, C., Gessa, G. L., & Franconi, F. (2016). Sex differences in substance use disorders: focus on side effects. Addiction Biology, 21(5), 1030–1042. Greenfield, S. F., Back, S. E., Lawson, K., & Brady, K. T. (2010). Substance Abuse in Women. Psychiatric Clinics of North America, 33(2), 339–355.
- Greenfield, S. F., Back, S. E., Lawson, K., & Brady, K. T. (2010). Substance Abuse in Women. Psychiatric Clinics of North America, 33(2), 339–355.
- Pötschke-Langer, M., Kahnert, S., Schaller, K., Verena, V., Heidt, C., Schunk, S., … Fode, K. (2015). Tabakatlas (1st ed.). Heidelberg: Deutsches Krebsforschungszentrum.
- Bobzean, S. A. M., DeNobrega, A. K., & Perrotti, L. I. (2014). Sex differences in the neurobiology of drug addiction. Experimental Neurology, 259, 64–74.
- Becker, J. B., McClellan, M., & Reed, B. G. (2016). Sociocultural context for sex differences in addiction. Addiction Biology, 21(5), 1052–1059.
- Pötschke-Langer M, Kahnert S, Schaller K, Viarisio V: Tabakatlas 2015. Deutsches Krebsforschungszentrum in der Helmholtz-Gemeinschaft (dkfz). Im Zusammenarbeit mit: Robert-Koch-Institut, Universität Hohenheim, Institut für Therapieforschung (IFT). Gefördert von: Bundesministerium für Gesundheit.
- Pötschke-Langer, M., Kahnert, S., Schaller, K., Verena, V., Heidt, C., Schunk, S., … Fode, K. (2015). Tabakatlas (1st ed.). Heidelberg: Deutsches Krebsforschungszentrum.
- Agabio, R., Campesi, I., Pisanu, C., Gessa, G. L., & Franconi, F. (2016). Sex differences in substance use disorders: focus on side effects. Addiction Biology, 21(5), 1030–1042.
- Minami, H., Kahler, C. W., Bloom, E. L., Prince, M. A., Abrantes, A. M., Strong, D. R., … Brown, R. A. (2014). Effects of sequential fluoxetine and gender on prequit depressive symptoms, affect, craving, and quit day abstinence in smokers with elevated depressive symptoms: A growth curve modeling approach. Experimental and Clinical Psychopharmacology, 22(5), 392–406.
- S3-Leitlinie “Screening, Diagnostik und Behandlung des schädlichen und abhängigen Tabakkonsums” AWMF-Register Nr. 076-006
- Agabio, R., Campesi, I., Pisanu, C., Gessa, G. L., & Franconi, F. (2016). Sex differences in substance use disorders: focus on side effects. Addiction Biology, 21(5), 1030–1042
- Agabio, R., Campesi, I., Pisanu, C., Gessa, G. L., & Franconi, F. (2016). Sex differences in substance use disorders: focus on side effects. Addiction Biology, 21(5), 1030–1042.
- Agabio, R., Campesi, I., Pisanu, C., Gessa, G. L., & Franconi, F. (2016). Sex differences in substance use disorders: focus on side effects. Addiction Biology, 21(5), 1030–1042.
Lizenz[Bearbeiten]
Dieser Artikel ist unter der Creative Commons Lizenz veröffentlicht. Den vollen Lizenzinhalt finden Sie hier: https://creativecommons.org/licenses/by/3.0/legalcode
Autoren[Bearbeiten]
Julia Schreitmüller
Zuletzt geändert: 2017-09-29 16:01:10
Ein Teilgebiet der Medizin, das die Verteilung von Krankheiten in einer Bevölkerung und die damit zusammenhängenden Variablen untersucht.
Die Anzahl neu aufgetretener Krankheitsfälle innerhalb einer definierten Population in einem bestimmten Zeitraum.
Die Häufigkeit einer Krankheit oder eines Symptoms in einer definierten Population zu einem bestimmten Zeitpunkt.
Zwanghaftes Bedürfnis bzw. unwiderstehlicher Drang nach einem bestimmten Stimulus (Reiz), z. B. einer chemischen Substanz (Droge).
Die Lehre von krankhaft veränderten Körperfunktionen sowie ihrer Entstehung und Entwicklung.
(oder Sekretionsphase) Die zweite Phase des weiblichen Zyklus, die unmittelbar auf den Eisprung folgt und mit dem Beginn der nächsten Menstruation endet (c. a. 15. bis 24. Zyklustag).
(engl.: craving = Verlangen) Starkes Verlangen nach einer bestimmten Substanzwirkung.
Beschreibt den beschleunigten Verlauf vom Initialkonsum einer Substanz über das Einsetzen der Abhängigkeit bis zur ersten Behandlung bei Frauen im Vergleich zu Männern. Ursächlich scheinen verschiedene biologische, sozioökonomische, psychologische und kulturelle Einflussfaktoren.
Die erste Hälfte des Menstruationszyklus (erster bis c. a. vierzehnter Tag), während der die Follikel im Eierstock heranwachsen und vermehrt Östrogene produzieren, wodurch sich die Gebärmutterschleimhaut wieder aufbaut.
Zwanghaftes Bedürfnis bzw. unwiderstehlicher Drang nach einem bestimmen Stimulus (Reiz), z. B. einer chemischen Substanz (Droge).
Biologisches Geschlecht